Asam,basa dan garam (Plassa).
Dalam kehidupan sehari-hari kita sering berhubungan dengan senyawa
asam, basa dan garam, bahkan hampir tiap hari kita selalu menggunakan
senyawa yang bersifat asam maupun basa. Kita pun tak lepas dari garam
karena hampir semua makan yang kita makan menggunakan garam. Untuk
memahami tentang asam, basa dan garam mari kita bahas bersama-sama.
A. Asam
Senyawa asam banyak kita
jumpai pada kehidupan sehari-hari. Semua senyawa asam mempunyai rasa
masam/kecut. Rasa masam/kecut ini desebabkan oleh adanya senyawa yang
bersifat asam. Buah-buahan memiliki rasa asam berkat adanya senyawa asam
yang dikandungnya. Jeruk mengandung asam sitrat sedangkan anggur
mengandung asam tartrat. Air susu yang basi mengandung asam laktat.
Selain itu, senyawa asam dapat kita temukan juga dalam lambung dan
darah. Dalam lambung terdapat asam klorida yang berperan pada pencernaan
makanan serta dalam darah terdapat asam karbonat dan asam phosfat yang
berperan pada pengangkutan makanan. Perhatikan tabel berikut.
Tabel 1.1 Beberapa Asam dan Sumbernya
1. Ciri-Ciri Asam
a. Rasanya asam
b. Dapat mengubah warna kertas lakmus biru menjadi merah
c. Mempunyai pH (derajat keasaman) kurang dari 7
d. Dapat menghantarkan listrik (termasuk larutan elektrolit)
e. Dengan logam tertentu dapat mengahasilkan gas hidrogen
f. Bersifat korosif atau merusak bahan-bahan benda-benda yang dikenainya
Meskipun asam adalah
senyawa yang sangat berguna, tetapi asam juga dapat menimbulkan berbagai
kerusakan pada bahan-bahan yang dikenainya karena asam bersifat
korosif. Salah satunya adalah peristiwa hujan asam. Berikut adalah
beberapa dampak yang ditimbulkan oleh hujan asam:
a. mungubah pH tanah sehingga kondisinya tidak sesuai dengan tumbuhan dan mengakibatkan pohon/tanaman mati.
b. dapat menghilangkan unsur-unsur hara dalam tanah sehingga mengurangi kesuburan tanah.
c. mengubah pH air sehingga dapat mematikan ikan-ikan dan biota-biota air.
d. merusak bangunan, terutama yang terbuat dari batu pualam (karbonat dan logam).
B. Basa
Seperti halnya asam, basa
juga banyak kita jumpai dalam kehidupan sehari-hari. Para ibu rumah
tangga menggunakan abu gosok untuk mencuci piring. Basa dalam abu gosok
dapat bereaksi dengan kotoran berupa lemak/minyak , sehingga menjadi
larut. Sedangkan, untuk mencuci piring yang sangat berminyak perlu
menggunakan sabun. Sabun dapat melarutkan lemak dan minyak. Para
penderita magh selalu minum obat berupa magnesium hidroksida atau
aluminium hidroksida.
1. Ciri-Ciri Basa
a. Pahit dan licin di kulit
b. Mempunyai pH lebih dari 7
c. Mengubah warna lakmus merah menjadi biru
d. Dapat menghantarkan listrik (termasuk larutan elektrolit)
e. Dapat menetralkan sifat asam
f. Bersifat kausatik atau dapat merusak kulit
Gambar 1.1 Sabun merupakan salah satu contoh zat yang bersifat basa
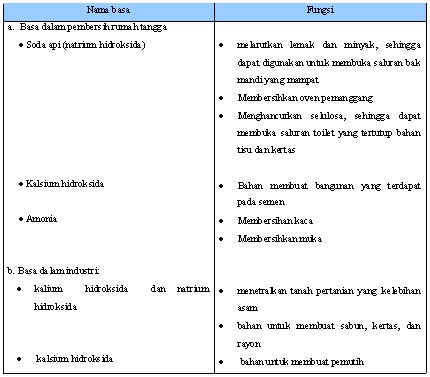
2. Peranan Basa dalam Kehidupan
Tabel 1.3 Beberapa Basa dan Fungsinya
C. Teori Asam Basa Arrhenius
Dari uraian di atas, salah
satu ciri dari asam adalah senyawa yang berasa asam dan memerahkan
lakmus biru sedangkan basa adalah senyawa berasa pahit dan licin di
kulit serta dapat membirukan lakmus merah. Ciri tersebut belum dapat
menjelaskan mengapa asam atau basa dapat menghantarkan listrik atau
dikenal dengan istilah elektrolit. Untuk itu, Svante August Arrhenius
mengajukan suatu konsep asam-basa yang di kenal sebagai teori asam-basa
Arrhenius.
Asam adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion hidrogen (H+). Semakin banyak ion H+,
semakin kuat sifat asamnya. Dengan demikian, dikenal asam kuat dan
asam lemah. Asam kuat dalam air terionisasi sempurna (semua terurai
menjadi ion), sedangkan asam lemah terionisasi sebagian (tidak semua
terurai menjadi ion). Perhatikan tabel berikut.
Tabel 1.4 Asam Kuat dan Reaksi Ionisasinya
Tabel 1.5 Beberapa Asam Lemah dan Reaksi Ionisasinya
Basa adalah senyawa yang jika dilarutkan ke dalam air menghasilkan ion hidroksida (OH-). Semakin banyak ion OH-,
semakin kuat sifat basanya. Dengan demikian, dikenal basa kuat dan
basa lemah. Basa kuat dalam air terionisasi sempurna (semua terurai
menjadi ion), sedangkan basa lemah terionisasi sebagian (tidak semua
terurai menjadi ion). Perhatikan tabel berikut.
Tabel 1.6 Basa Kuat dan Reaksi Ionisasinya
Tabel 1.7 Beberapa Basa Lemah dan Reaksi Ionisasinya
D. Garam
Dalam kehidupan sehari-hari
kita mengenal garam dapur yang biasa digunakan untuk bumbu masak. Garam
dapur merupakan salah contoh dari garam menurut ilmu kimia.
Seperti halnya asam dan basa, garam juga memiliki peranan yang sangat penting dalam kehidupan. Perhatikan tabel berikut.
Tabel 1.8 Beberapa Garam dan Fungsinya dalam Kehidupan Sehari-Hari
Adapun ciri-ciri dari garam antara lain:
1. Dalam bentuk leburan (cairan) atau lelehan dapat menghantarkan listrik
2. Sifat
larutannya dapat berupa asam, basa, atau netral tergantung jenis asam
(kuat atau lemah) dan basa (kuat atau lemah) pembentuknya.
a. asam kuat dan basa kuat akan terbentuk garam yang bersifat netral
b. asam kuat dan basa lemah akan terbentuk garam yang bersifat asam
c. asam lemah dan basa kuat akan terbentuk garam yang bersifat basa
E. E. Tingkat Keasaman (pH)
Tingkat keasaman merupakan
ukuran besar kecilnya pH yang menunjukkan skala keasaman dan kebasaan
suatu larutan, angkanya sekitar 0 sampai dengan 14 dengan ketentuan
sebagai berikut.
1. Larutan asam memiliki pH<7
2. Larutan basa memiliki pH>7
3. Larutan netral memiliki pH=7
F. Indikator
Indikator adalah bahan/alat yang digunakan untuk mengenali sifat suatu senyawa (asam, basa atau netral).
Macam-macam Indikator:
Macam-macam Indikator:
1. Indikator alami
Indikator alami diperoleh
dari bagian tumbuhan berwarna dapat berupa bunga, daun, buah, biji, atau
akarnya. Contohnya, kunir, bunga sepatu merah, kulit manggis, dan
lain-lain.
Misalkan kulit manggis,
kulitnya digerus sampai halus kemudian dituangi pelarut (alkohol) dan
selanjutnya airnya dipisahkan melalui penyaringan. Ekstrak kulit
manggis tersebut di teteskan pada senyawa yang bersifat asam atau basa,
contohnya adalah larutan asam (HCl) atau basa (NaOH), maka:
- Pada larutan asam : terjadi perubahan warna dari ungu menjadi coklat kemerahan
- Pada larutan basa: terjadi perubahan warna dari ungu menjadi biru kehitaman
2. Indikator buatan
a. Kertas lakmus
b. Kertas indikator universal
c. Larutan
Tabel 1.10 Beberapa Indikator Larutan dan Perubahan Warnanya
d. pH meter/pH digital
G. Reaksi pada Asam, Basa, dan Garam
- Logam + asam -------> gas hidrogen + garam
Contoh: besi + larutan asam asetat ----------> gas hidrogen + besi(II) asetat
Fe(s) +2CH3COOH ----------> H2(g) +Fe( CH3COO)2(aq)
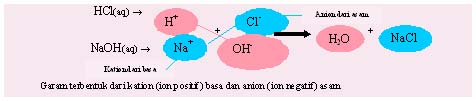
- Asam kuat + basa kuat ---------> garam (bersifat netral) + air
Contoh: Larutan asam klorida + larutan natrium hidroksida ---> larutan natrium klorida + air
HCl(aq) + NaOH(aq) ---> NaCl(aq) + H2O(l)
- Asam lemah + basa kuat ---> garam (bersifat basa) + air
Contoh: Larutan asam phosfat + larutan natrium hidroksida --> larutan natrium phosfat + air
H3PO4(aq) + 3NaOH(aq) --> Na3PO4(aq) + 3H2O(l)
- Basa lemah + asam kuat --> garam (bersifat asam) + air
Contoh: Larutan ammonium hidroksida + larutan asam sulfat --> larutan ammonium sulfat + air
2NH4OH(aq) + H2SO4(aq) --> (NH4)2 SO4(aq) + 2H2O(l)
- Oksida logam (oksida basa) + asam --> garam + air
Contoh: natrium oksida + larutan asam nitrat --> larutan natrium nitrat + air
Na2O(s) + HNO3(aq) ---> NaNO3(aq) + H2O(l)
- Oksida nonlogam (oksida asam) + basa ---> garam + air
Contoh: gas karbon dioksida + larutan kalsium hidroksida --> endapan kalsium karbonat + air
CO2(g) + Ca(OH)2(aq) ---> CaCO3(s) + H2O(l)